=文献名=
Donner-Banzhoff N. Solving the Diagnostic Challenge: A Patient-Centered Approach.
Ann Fam Med. 2018 Jul;16(4):353-358. doi: 10.1370/afm.2264.PMID: 29987086
=要約=
Abstract
臨床上の問題について合意された妥当な説明を得ることは、臨床医だけでなく患者にとっても重要である。臨床医がどのようにして診断にたどり着くかについての現在の理論(閾値アプローチや仮説演繹的モデルなど)は、総合診療における診断プロセスを正確に記述していない。総合診療における確率空間は非常に大きく、各疾患が存在する事前確率は非常に小さいため、診断プロセスを臨床医の可能性リスト上の特定の診断に限定することは現実的ではない。ここでは、患者と臨床医が特定の方法で協力する方法についての新たなエビデンスが議論されている。診断課題をナビゲートすることと、患者中心の医療面接を利用することは、別々の作業ではなく、むしろ相乗効果がある。
Introduction
フランス映画『Irreplaceable』で、田舎の高齢医師が健康上の理由で診療を断念せざるを得なくなり、彼は患者に若い同僚の医師を後任として紹介した。ある中年の患者が最近発症した頭痛の治療を受けようとしている。若い医師はすぐに直接質問をして、場所、重症度、関連する特徴を明らかにしようとしたが、この非常に尖った質問からは明確なイメージが浮かび上がらない。高齢医師は、診察の最初に患者が何か言いたがっていることに気付いていたが、若い医師に遮られてしまった。高齢医師が促すと、患者は糖尿病のために新しい薬を飲み始めてから頭痛が始まったと説明する。
医師がどのようにして診断にたどり着くかは、多くの議論の対象となっているが、実証的研究はあまり行われていない。特にプライマリ・ケアのようなジェネラリストの設定では、認知的課題は膨大である。しかし、これまでの理論では、臨床医がどのように対処するかを十分に説明できていない。ここでは、プライマリ・ケアの意思決定に関する最近のエビデンスに基づいた新しいアプローチを提案する。
まず、診断プロセスに関するこれまでの理論を見直し、プライマリ・ケアの環境特性との適合性を論じる。最近出てきた証拠に基づいて、ジェネラリストの診断プロセスの異なる概念化を提示する。
臨床決断に対する閾値アプローチ(threshold approach)
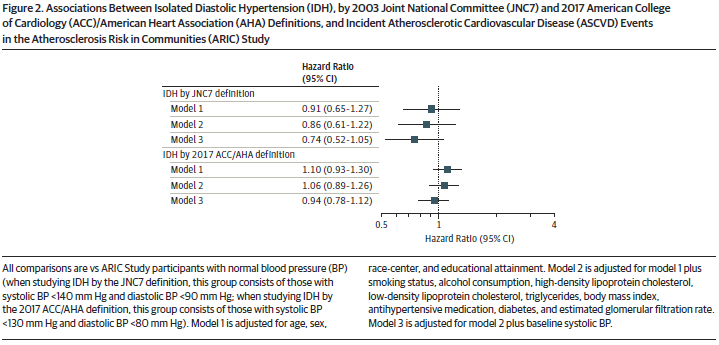
1980年、PaukerとKassirerは診断の閾値モデルを提案した。このモデルでは、医師が特定の疾患を検討しているとき、取られる行動は2つの閾値、つまり治療閾値と診断閾値に依存すると仮定する(図1)。疾患の確率が治療閾値を超えると、医師は診断プロセスを終了し行動を起こす。この行動は治療であるかもしれないが、状況に応じて、紹介などの他の手段も考えられる。
一方で、もし疾患の確率が診断閾値を下回った場合、医師は病気が存在しないと考え、その診断を確定するか否かを判断するためのデータ収集を終了する。疾患の確率が診断閾値と治療閾値の間にある限り、治療閾値を上回る(疾患が存在すると仮定する)か,診断閾値を下回る(疾患が存在しないと仮定する)ことにより症例が解決するまで、さらなる診断検査が正当化される。
診断閾値と治療閾値が設定される確率値に影響を与える要因には、疾患の重症度、検査や治療の利点と弊害がある。閾値を計算するための他の形式的なモデルも提案されている。後者は、閾値モデルが臨床医が自分自身の価値観や患者の価値観に合わせて診断を行うのに役立つ場合に適用される。
閾値モデルには直感的な魅力があるが、プライマリ・ケアにおける最近の研究では、特定の仮説の明示的な検証(演繹的検証)は診断エピソードの40%未満でしか行われていないことが示されている。特定の疾患仮説に向けられていない戦略の方が一般的であり、仮説検証よりも診断上の手がかりをより多く得ることができる。すべての診療において、疾患の確率が2つの閾値のうち1つの閾値を超えて意思決定に至るとは限らない。急性・重篤な疾患が除外された後、臨床医は待機的戦略(watchful waiting)を用いる。最後に、閾値モデルは医師に焦点を当てたもので、この見解では患者は完全に受動的な立場である。この見解は、患者が臨床決断(診断)に積極的に参加していることを示す実証的研究と矛盾している。
臨床問題空間(Clinical problem space)の環境特性
閾値アプローチでは、臨床的確率空間は明確に境界があり、ほとんどが特定可能な疾患で埋め尽くされていると仮定する。しかし、この仮定はプライマリ・ケアにおいては当てはまらない。例えば、胸痛を呈する患者でも、急性冠症候群を有する患者は1.5%から3.5%に過ぎない。肺塞栓症、解離性大動脈瘤、その他多くの生命を脅かす疾患は、プライマリ・ケアでは定量化することすらできないほど稀である。言い換えれば、閾値モデルを真面目に考えれば、ほとんどの重篤な疾患は診察の最初に除外すべきだと考えるだろう。
エビデンスに基づく医学の共通の考え方は、病気を除外するためには、感度の高い検査が好ましいということである(略語で「snout」)。しかし、低有病率の環境では、検査後に疾患が存在する可能性、つまり疾患の陰性予測値は常に小さい。感度の高い検査でさえ、この低い確率を有効に修正することはできない。例えば、プライマリケアで胸痛を呈する患者では、急性冠症候群の有病率は約2.5%である。患者がかなり若く(女性であれば65歳以下、男性であれば55歳以下)、胸の圧迫感や絞扼感を感じない場合、その確率は0.26%に低下する。しかし、冠動脈疾患が判明していたり、緊急の往診依頼があったりするような陽性所見がある場合には、診断閾値を超えて臨床的に有意な42%まで上昇する。言い換えれば、有病率が低い場合には、感度の高い検査は多くの場合役に立たないということである。
この状況は、診断プロセスの開始時に疾患の確率が診断閾値以上で治療閾値以下であるという閾値モデルの暗黙の仮定と矛盾している。そもそもプライマリ・ケア医はどのようにして最初から診断閾値以上の疾患の確率に到達するのだろうか?
医師は多くの潜在的に重篤な状態を除外しなければならないため、その課題はさらに大きくなる。さらに、プライマリ・ケアではほとんどの症状が曖昧であり、たとえ関連が薄くても、いくつかの異なる説明が可能である。最後に、多くの臨床的に重要な健康問題は、従来の疾患分類では捉えられない。
空間の探索
特に患者との出会いの初期段階において医師が実際に行っていることについては、このように新たな記述が必要となる。医師がまずこの拡大した問題空間を探索し、ここで患者が主導的役割を担っているというモデルを提案する。
帰納的渉猟(inductive foraging)と誘発されるルーチン(triggered routines)
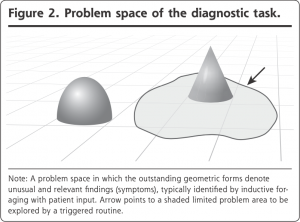
282件のプライマリケア診察と163件の診断エピソードを分析した結果、特定の仮説を立てる前に、帰納的渉猟(inductive foraging)と呼ばれるプロセスがあることが明らかになった。このプロセスは、患者が自分の症状を説明するように患者に最初に促すものである。通常、それは患者が現在の訴えとして記録されていることを述べることをはるかに超えたものである。患者は自発的に更なる症状や機能的な関連性、そして多くの場合、自分自身の説明や懸念事項についても言及する。もし患者が干渉することなくそうすることが許されるならば、患者は臨床医を症状や問題点に誘導し、問題空間の探索を提供することになる。
いくつかの例を挙げると、疲労感があり気分が落ち込んでいる63歳の男性が、最近シャツのボタンを留めるのに苦労していることを話してくれ、初期のパーキンソン病のヒントを与えてくれる。67歳の定年退職した配管工の男性が、最近頻繁に咳をしていると報告する。喀痰検査をオーダーするかどうかを考えていると、彼が定期的に地元の吹奏楽団でチューバを演奏していることに言及しているのを聞き逃すところだったことに気付き、医師は彼の肺機能が問題ないと安心する。
ほぼ無限の確率空間を背景にして、医師が直接質問をして、ほとんどがクローズドエンドな質問をすることは、ジェネラリストの設定では現実的ではない。一旦患者の話が遮られると、患者は通常受動的なモードに切り替わり、医師が思いつく問題に関連した質問にのみ答えるようになる。このような早期閉鎖の後では、重要で予想外のポイントが見落とされることは明らかである。この結果は、薬物誘発性頭痛についての紹介例を見れば明らかである。あの若い医師が薬物の有害事象という仮説に自力でたどり着く可能性は低く、たどり着くとしたら長い質問とあれこれ悩んだ後にのみ到着したであろう。患者に病像を話すのに十分な時間を最初に確保し、積極的傾聴により患者の話を促すことは、患者にとって親身というだけでなく、診断を豊かにし診察の効果性を高めることにもつながる。
患者の助けを得て問題空間が定義された後に、医師はその限られた領域を直接的な質問によって探索する。しかし、この探索は特定の仮説に従うものではなく、このプロセスを誘発されるルーチン(triggered routines)と呼ぶ(図2)。例えば、嘔吐を訴える患者は腹痛と排便について尋ねる。冒頭の若い医師が患者に頭痛の性状について質問するのは別の一例である。帰納的渉猟と誘発されるルーチンは、明確な仮説を必要としない。仮説をあまりに早期に検証するのは、重要な情報が失われる可能性があるため、ともすれば有害である。以前の調査で示されているように、これらの探索的戦略は十分な情報が得られるため、特定の診断仮説が必要な診療は全体の半分未満だった。この残りの少数派についてのみ、プライマリ・ケア医は、Elsteinらによる独創的に富む研究に端を発する仮説演繹モデルが提唱するような特定の診断仮説によって導かれる追加データを収集する必要がある。
診断の仮説演繹モデル
仮説演繹モデルは、医学における診断推論理論として今でも支配的な理論である。このモデルによると、患者との出会った初期の段階で、
医師は可能性のある説明(仮説)がいくつか浮かぶ。これらの仮説に従い、確定または除外を目的としたさらなるデータ収集が行われる。このモデルは、導入された当時は画期的だったが、標準化された模擬患者を評価する一方で、病院勤務医が自らの推論を省察する様子(思考発話)を観察することに基づいていた。しかし、このセッティングでは、実際のプライマリ・ケア患者よりも特定の仮説を想起する可能性が高くなる。というのもプライマリ・ケアでは患者の症状を生物医学的枠組みの範疇で十分に説明できないことが多いのである。
確証バイアスか、合理的反証戦略か
臨床推論の誤りに関する文献では、診断エラーの原因として確証バイアスが頻繁に言及されている。このバイアスの影響を受けると、医師は自分が抱いている仮説を確かなものとする情報のみを探し集め、矛盾する結果を無視してしまうことになる。ただし、広い問題空間を探索する必要がある場合は、疾患の存在を示す証拠に注目するという本来なら批判される行為こそが理にかなった戦略になる。
上記で示唆したように、プライマリ・ケア診断は、深刻な状態を除外できるという前提から始まる。診療の間に、この仮定をもとに、特定の疾患が存在する場合、さらなる検査につながることを示唆する所見を探索することにより、極めて重要な検査が行われ、もし所見があればさらに追及する。言い換えれば、医師は反証戦略を用いて、上記の通り問題空間を探索する。この早期段階では、陰性所見の確認に労力を使うことはない。なぜなら、陰性所見がもたらす情報はあまりないからである。したがって、疾患の有病率が低い限り、医師は示唆的な陽性所見を探求するのは至極当然のことである。特定の診断の可能性がその方向を指し示す所見によってその疾患の可能性が高くなってからでなければ陰性所見は意味をなさない。
このプロセスでは、医師は特定の疾患と病理学的所見(症状、徴候、検査異常など)が50%よりもはるかに少ない頻度で発生するという事実を利用する。疾患が存在しないという当初の仮説に反して、医師は特定の疾患を示唆する所見を求めて問題空間を探索する。この段階では特異性の高い診断基準が特に役立つのは明らかである。もしそのような診断基準が満たされている場合、高い確率で疾患が存在することになる。このような基準が存在するからといって、ほかの特定の病気にも特異的であることを必ずしも意味しない。プライマリ・ケア医は、多数の病気を管理しやすいように疾患をグループ化する(例:「厄介な難解なウイルス」というように)。所見があることで探索を深める価値のある領域がわかるなら、その所見は有用である。呼吸器感染症の患者が呼吸困難の症状に言及していると、良性で自然治癒する疾患だろうという第一印象を翻して、新しい探索が行われるだろう。こうして狭まった問題空間には、肺炎、閉塞性肺疾患、またはうっ血性心不全が含まれる場合がある。「レッドフラッグ」の概念は、特定の仮説を必ずしも念頭に置かずに問題空間を探索するという考え方に近い。何かが合わない、何かがおかしいという奇妙な印象も同様に役立つ。
患者の関与を必要とする適応戦略
特定の兆候が仮に複数なかったとしても、関連疾患が十分除外できるわけではなく、そのためには問題空間の帰納的かつ協調的に徹底して探索することによってのみ除外できる(図2)。そのためには、堂々といつもと違うことや、心配していることをすべて話すだけの、またはその両方のすべてのことに言及するのに十分な時間と動機が患者にあることが不可欠ある。威圧的な態度で業務をしていたり、帰納的渉猟で患者の治療を早期で遮断したりする医師は望みが薄い。薬物誘発性頭痛の導入例が示すように、そのような医師は症状を説明できるあらゆる仮説の想起と関連情報の収集をすべて自分で行わなくてはならないため、重要な所見や仮説がどうしても見逃されてしまう。したがって、診断プロセスの精度は、臨床医と患者の関係の質に大きく依存する。ここで述べた最初の病歴聴取と診察のアプローチは、画像検査や侵襲的検査などにおけるshared decision makingにも活用できる可能性がある。
人間は、自分の認知戦略をおかれている環境と手を付けている業務に適応させる。Elsteinらの独創的な研究に参加していた医師は、演者が演じた症例や紙に記載された事例が明確な正解があるものと考えていたに違いない。実際にはそうではなく、医師は潜在的に無限の問題空間の別の課題に直面し、患者の所見も多様かつ曖昧で、医学的に説明がつかないことが多い。問題空間が十分狭くなったものの関連情報がまだ見つかっていない段階になって初めて、医師は戦略を仮説演繹法に切り替える。
上記の現象学は、医学的診断に関連するほかのプロセス(直観、経験則、パターン認識)を除外するものではない。医師が適切な症状および徴候をすべて把握しているときに有効に働く。帰納的渉猟は、不適当な結論に勇んでたどり着いてしまうことを防ぐことができる。
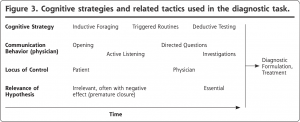
患者と医師が協働して問題空間を探索することが、プライマリ・ケアの診断プロセスの現象学を描写するのに最も適当である(図3は、関連する戦術と潜在的なピットフォールを示している)。この協働的探索のモデルは、以前に定式化された理論、特に閾値モデルと仮説演繹モデルに対しての批判に応えるものである。関連データの大半はプライマリ・ケアから得られたものだが、このモデルは複数の疾患が関心の対象となっている臨床セッティングであれば、いかなる場合でも適用できると考えている。
Conclusion
患者中心性(patient-centeredness)は、McWhinneyやStewartらによって、優れた家庭医療の本質的な特徴であると説得力を持って主張されてきた。しかしながら、患者中心性は一般的に適応されているとは言い難く、傾聴の失敗は臨床医に対する最も多い批判の一つである。効果的な関係を築くことと診断を行うことは別のスキルと思われがちであるが、これらは相乗効果があることを強調したい。診断の効率化は、患者の貢献なしには非常に難しい。
プライマリ・ケアにおける診断プロセスに関するキーメッセージ
・ジェネラリストの診療では、起こりうる問題(診断)の問題空間はほぼ無限大である。
・最近の研究では、すでに確立された他の方法論では、臨床医が診断に到達するために何をするかを十分に把握できていないことが示唆されている。
・inductive foragingとtriggered routinesによる問題空間の探索は、ジェネラリストの診療に適応できる診断戦略として浮上してきている。
・患者はこの共同作業の中で主導的な役割を担っている。
【開催日】2020年7月22日(水)